سلامت
2 دقیقه پیش | نشانه ها و عوارض کمبود ویتامینها در بدنویتامینها نقش مهمی را در بدن انسان ایفا میکنند. بهنحویکه کمبود ویتامین (حتی یکی از آنها) میتواند برای هر فردی مشکلات اساسی را به وجود آورد. گجت نیوز - معین ... |
2 دقیقه پیش | چرا پشه ها بعضی ها را بیشتر نیش میزنند؟فصل گرما و گزیده شدن توسط پشه ها فرا رسیده، دوست دارید بدانید پشه ها بیشتر چه کسانی را دوست دارند؟ بیشتر کجاها می پلکند؟ و از چه مواد دفع کننده ای نفرت دارند؟ وب سایت ... |
آیا صرع زمینه ژنتیکی و ارثی دارد؟
مطالعات نشان داده که خطر ابتلا به صرع در فرزندانی که مادر مبتلا دارند، دو برابر بیش از کودکانی بوده که پدر مبتلا به صرع داشته اند.
مجله دنیای سلامت - دکتر حسین دلاور کسمایی، متخصص مغز و اعصاب:
وراثت چیست؟
ژنتیک علم بررسی ژن هاست. ژن ها واحدهای بنیادین وراثت اند.
بدن انسان ها از هزاران ژن تشکیل شده است که هریک بر ویژگی های معنی اثرگذارند. ویژگی هایی مانند رنگ مو، رنگ چشم، گروه خونی، و بسیاری خصوصیت های دیگر. بنابراین هر فرد با درنظر گرفتن این ویژگی ها از دیگران متفاوت است چرا که ژن های متفاوتی به ارث برده است. مثلا فرزندان به یکی یا هر دو والد خود شباهت دارند یا خصوصیت هایی شبیه به پدربزرگ، مادربزرگ و یا خویشان خود دارند. به همین دلیل ژن های خاصی از یک نسل به نسل بعد به ارث می رسد.
در گذشته تصور بر این بوده است که هر فرد به دلیل کروموزم های خاص خود خصیصه های متفاوتی دارد.
اما تفاوت ژن و کروموزم در چیست؟
راه ساده برای درک کروموزوم درنظر گرفتن آن به عنوان جعبه ای انباشته از تعداد بسیاری ژن است.
بدن انسان از میلیون ها سلول تشکیل شده است. این سلول ها نواع متفاوتی دارند (سلول های مغزی، سلول های ماهیچه ای، سلول های پوستی و...) که بیشتر آنها محتوی کروموزوم هستند. هریک از سلول ها 23 جفت یعنی 46 عدد کروموزوم در خود دارند و هریک از کروموزوم ها، یک جفت از پدر و دیگری از مادر به فرزند منتقل می شود. ژن ها درواقع بر روی کروموزوم ها قرار دارند و از این رو از هر دو والد به فرزند انتقال یافته اند.
هر ژن خود از ماده دیگری به نام DNA شکل گرفته است. ژن ها به هر سلول دستورالعمل هایی برای تولید پروتوئین هایی را می دهند که برای انجام اعمال طبیعی بدن ضروری اند.
فاکتورهای دیگر موثر بر وراثت (در صرع)
1- سن ابتلا به صرع، فرزندان والدینی که حمله های تشنجی آنها در سال های آغازین زندگی پدیدار شده است (مثلا پیش از 20 سالگی) بیش از فرزندانی که والدینشان دیرتر به حمله های تشنجی مبتلا شده اند، مستعد ابتلا هستند.
2- مادر و پدر مبتلا به صرع. مطالعات نشان داده که خطر ابتلا به صرع در فرزندانی که مادر مبتلا دارند، دو برابر بیش از کودکانی بوده که پدر مبتلا به صرع داشته اند. پژوهش ها بیانگر این است که این امر متاثر از مسائل بارداری و زایمان، حمله های تشنجی مادر در دوران بارداری یا مصرف داروهای ضدصرع در طول مدت بارداری نیست و پژوهش های بیشتری برای تشریح چگونگی این تفاوت نیاز است.
3- مدت ابتلا. به نظر می رسد، خطر ابتلا به صرع در مقایسه با جمعیت کلی در خویشاوندان افرادی که به دلیل صدمه های مغزی همچون سکته مغزی، ضربه شدید سر و یا عفونت های مغزی دچار صرع شده اند، افزایش نمی یابد.
امکان اختلال در عملکرد هر یک از اجزا
آنچه مسئله را پیچیده می کنند این است که ژن ها می توانند به شیوه های مختلفی تغییر کنند. در اصل تغییراتی که در DNA رخ می دهد می تواند منجر به اختلال در کارکرد طبیعی پروتئین یا حتی توقف کارکرد آنها شود. این پدیده موتاسیون نام دارد. به علاوه فاکتروهای محیطی نیز می توانند بر نحوه عملکرد سلول ها اثرگذار باشند. برخی از انواع موتاسیون می تواند منجر به بیماری شده و برخی نیز ممکن است به نسل های بعد منتقل شود.
آیا صرع یک اختلال وراثتی است؟
بعضی از انواع صرع موروثی اند. صرع یک بیماری منفرد نیست، بلکه مجموعه ای از اختلال هایی است که همگی در تمایل به بروز حمله تشنج در فرد مبتلا اشتراک دارند. وقتی صفت های فردی توسط یک ژن واحد، پدید می آیند، صفت های ژنتیکی ساده محسوب می شود. تنها انواع بسیار نادری از صرع به دلیل تغییر در تنها یک ژن به وجود می آیند و به نظر می رسد بسیاری از انواع صرع در نتیجه مجموعه تعامل هایی بین ژن های چندگانه به علاوه تاثیرهای محیطی، بروز کرده باشند.
کدام یک از انواع صرع بیشتر از بقیه موروثی است؟
ظاهرا بستگان افراد مبتلا به صرع ژنرالیزه (یعین افرادی که براساس الگوی بررسی دستگاه نوار مغز، هر دو بخش مغزشان در زمان حمله تشنج درگیر است) بیش از بیماران مبتلا به صرع پارشیال (افرادی که براساس الگوهای بررسی EEG حمله تشنجی شان در بخش واحدی از مغز آغاز می شود) مستعد ابتلا به حمله تشنجی هستند. والدینی که سابقه حمله صرع ابسانس ژنرالیزه دارند نسبت به بیماران مبتلا به دیگر انواع حمله ژنرالیزه یا فوکال، بیشتر احتمال داشتن فرزندانی با همان شرایط را دارند.
امکان حذف صرع از یک نسل
همان طور که پیش از این گفته شد، بیشتر انواع صرع محصول مجموعه ای از ژن و تاثیرات محیطی است. به این ترتیب امکان عدم انتقال صرع از نسلی به نسل بعد وجود دارد. درواقع تمام افراد مبتلا، موجد انتقال و ایجاد صرع در نسل بعدی نیستند. بنابراین اگر ژن ها به نسل بعد منتقل شوند، تمام افراد خانواده مبتلا نخواهندشد.
عوامل موثر بر انتقال صرع از والدین به کودکان
پزشک مشاور می تواند به این مساله پاسخ دهد، پزشکان و پرستارانی که در این زمینه آموزش های تخصصی دیده اند، مشاوران ژنتیک و دیگر متخصصان سلامت می توانند به فرد مبتلا در امر بررسی سابقه پزشکی، سابقه بیماری در خانواده و در صورت امکان محاسبه ریسک ابتلای کودک به صرع کمک کنند و پیشنهادهایی برای انجام آزمایش های خاصی ارائه دهند.
اگرچه شواهد بسیاری درباره نقش اساسی ژن در ابتلا به صرع وجود دارد، آنچه مهم است تشخیص نوع ژن هایی است که در این امر دخیل اند، مسئله ای که هنوز در بسیاری از افراد مشخص نیست.
بررسی خانواده افراد مبتلا به صرع می تواند به دانش ما در این زمینه و احتمالا یافتن راه های تازه ای در امر درمان و حتی پیشگیری از ابتلا به آن منجر شود.
امکان انتقال صرع از والدین به فرزندان
به نظر می رسد که انواع معینی از صرع در خانواده منتقل می شود. برخی بررسی ها نشانگر این امر هستند که خطر ابتلا به صرع در خواهران، برادران و فرزندان افراد مبتلا به اختلال های تشنجی چهار تا هشت درصد است. (به عبارت دیگر، چیزی حدود یک در 25 و تا یک در 12) در حالی که خطر ابتلا در جمعیت عمومی حدود یک تا دو در صد است. (بین 1 درصد و یا 2 درصد).
با این وجود باید به یاد داشته باشیم که هرچند خطر در خانواده افراد مبتلا به صرع بیشتر است، اما بسیاری از مبتلایان به صرع هیچ خویشاوند مبتلا به صرعی ندارند و اکثر والدین مبتلا به صرع نیز فرزند مبتلا به صرعی ندارند.
ویدیو مرتبط :
زندگی ارثی ما
خواندن این مطلب را به شما پیشنهاد میکنیم :
تالاسمی یک بیماری ارثی-ژنتیکی

تالاسمی نوعی کم خونی ارثی و ژنتیکی است که به علت اشکال در ساخت زنجیرههای پروتئینی هموگلوبین بوجود میآید.هموگلوبین مولکول اصلی داخل گویچههای قرمز است که از هم و زنجیرههای پروتئنی یا گلوبین تشکیل شده است. در هر زنجیره گلوبین یک مولکول هم وجود دارد که اکسیژن را توسط آهن خود حمل میکند. پس تولید هموگلوبین نیاز به تامین آهن و ساخت هموگلوبین دارد بر اساس نوع زنجیره پروتئینی چند نوع هموگلوبین وجود دارد:
هموگلوبین A: هموگلوبین طبیعی در بالغین عمدتا همولگوبین A میباشد که تقریبا حدود 98% از هموگلوبین جریان خون را تشکیل میدهد و از زنجیره 4 تایی حاوی دو زنجیره آلفا و دو زنجیره بتا ساخته میشود. (α2β2)
HGbA2: هموگلوبین A2 از 2 زنجیره آلفا و 2زنجیره بتا تشکیل میشود.(α2δ2) که بطور طبیعی 2-1% هموگلوبین در بالغین را تشکیل میدهد.
HGbF: هموگلوبین F که هموگلوبین اصلی دوران جنینی است و کمتر از 1% هموگلوبین در بالغین را نیز شامل میشود،از زنجیره 4 تایی 2 تا آلفا و 2 تا گاما (α2δ2) تشکیل گردیده است و هموگلوبین های C , H و ... که در بعضی بیماریها بوجود میآید.
برای ساخت زنجیره بتا هر فرد از هر والد خود (پدر و مادر) یک ژن سازنده این زنجیره را دریافت میکند و برای زنجیرههای δ,α از هر والد 2 ژن دریافت میکند. و بر اساس جهش یا حذف هر کدام از این ژنها ساخت و زنجیره مربوطه مختل شده و انواع بیماری تالاسمی را خواهیم داشت.
هموگلوبین نه تنها برای حمل و تحویل طبیعی اکسیژن لازم است، بلکه در شکل و اندازه و بدشکلی گلبول قرمز دخالت دارد. مقدار کل هموگلوبین خون بطور طبیعی در خانمها 2±12 و در آقایان 2±14 گرم در دسیلیتر میباشد.
انواع تالاسمی
تالاسمی به دو نوع آلفا تالاسمی و بتا تالاسمی است که خود بتا تالاسمی هم شامل تالاسمی ماژور (تالاسمی شدید) و تالاسمی مینور یا تالاسمی خفیف میباشد. افراد مبتلا به تالاسمی مینور در واقع کم خونی مشکلسازی ندارندریا، ولی اگر دو فرد تالاسمی مینور با هم ازدواج کنند به احتمال 25% فرزندنشان دچار تالاسمی شدید ماژور خواهد بود و 25% فرزندشان سالم و 50% تالاسمی مینور خواهند داشت.
تالاسمی ماژور
تالاسمی ماژور یا آنمی کولی به علت حذف یا جهش در هر دو ژن سازنده زنجیره بتا ایجاد میشود و به این ترتیب یا هیچ زنجیره بتایی ساخته نمیشود و یا به مقدار کمی ساخته میشود. در نتیجه بدن کمبود این زنجیرهها را با ساخت زنجیرههای آلفا جبران میکند که این زنجیرههای آلفای اضافی برای گلبولهای قرمز سمی هستند و با رسوب بر روی سلولهای گلبول قرمز باعث میشوند که گلبولهای قرمز در مغز استخوان و در داخل خون تخریب شده و زنجیرههای آلفا در مغز استخوان رسوب میکنند. از طرفی به علت خونسازی غیر موثر ، مراکز خونساز خارج مغز استخوان ، ار جمله کبد و طحال شروع به خونسازی میکنند و بزرگ میشوند.
بیماری معمولا بصورت کم خونی شدید در 6 ماهه اول زندگی کودک تظاهر میکند و درصورت عدم شروع تزریق خون ، بافت مغز استخوان و مکانهای خونساز خارج مغز استخوان فعال و بزرگ شده و باعث بزرگی مغز استخوانها بخصوص استخوانهای پهن (صورت و جمجمه) و بزرگی کبد و طحال میشوند.

علایم بیماری
کم خونی شدید طوریکه برای بقاء بیمار تزریق مکرر خون لازم است.
افزایش حجم شدید مغز استخ
وان بخصوص در استخوانهای صورت و جمجمه ، چهره خاص افراد تالاسمی را ایجاد میکند (چهره موش خرمایی).
اختلال رشد دربچههای بزرگتر
رنگ پریدگی ، زردی و گاهی پوست ممکن است به دلیل رنگ پریدگی و یرقان و رسوب ملانین به رنگ مس در آید.
بزرگی کبد و طحال ، در سنین بالاتر گاهی طحال به حدی بزرگ میشود که باعث تخریب بیشتر گلبولهای قرمز میشود.
علایم ناشی از رسوب آهن در بافتهای مختلف از جمله پانکراس و قلب و غدد جنسی و ایجاد دیابت و نارسایی قلبی و تاخیر در بلوغ.
استخوانها نازک شده و مستعد شکستگی میشوند.
تشخیص
در آزمایش خون تالاسمی ماژور گلبولهای قرمز خون کوچک و کم رنگ خواهد بود (کم خونی هیپوکروم میکروسیتر). افت شدید هموگلوبین به مقادیر کمتر از 5 گرم در دسی لیتر وجود دارد. بیلی روبین سرم به علت تخریب سلولها افزایش مییابد و سایر آزمایشات که لزومی برای گفتن همه آنها نیست. تشخیص قطعی با الکتروفورز هموگلوبین انجام میشود که در تالاسمی ماژور هموگلوبین A طبیعی ساخته نمیشود و 98% هموگلوبینها را هموگلوبین F تشکیل میدهد و هموگلوبین A2 نیز تا 5% افزایش پیدا میکند.
عوارض
از عوارض تالاسمی یک سری از عوارض از جمله اختلال رشد و تغییر قیافه بیمار و بزرگی کبد و طحال که به علت خود بیماری است و یکسری عوارض دیگر ناشی از درمان تالاسمی است. اصلیترین این عارضه هموسیدوز یا هموکروماتوز است.
هموسیدروز به رسوب آهن در بافتها گفته میشود که نتیجه غیر قابل اجتناب تزریق طولانی مدت خون است. در هم نیم لیتر خونی که به بیمار تزریق میشود، حدود 200mg آهن به بافتها منتقل میکند که این مقدار آهن نمیتواند از بدن دفع شود و در بافتها رسوب میکند و باعث نارسایی در بافتها میگردد. بخصوص رسوب آهن در قلب و پانکراس و غدد ، مشکل اصلی این بیماران خواهد بود که باعث نارسایی پانکراس و دیابت ، نارسایی قلبی و نارسایی غدد جنسی و تیروئید و ... میشود.
درمان
تالاسمی شدید و درمان نشده همیشه باعث مرگ در دوران کودکی میگردد. در صورت تزریق مکرر خون و حفظ سطح مناسبی از خون میتوان طول عمر ا افزایش داد و تا حد زیادی مانع از تغییرات استخوانی و اختلال رشد گردید. پس درمان تالاسمی عبارتند از:
تزریق دراز مدت خون: هدف از تزریق خون مکرر برای بیمار حفظ هموگلوبین بیمار در سطح بالای 10 است.
دفروکسامین: مشکل اصلی بیماران تالاسمی بعد از سالها ، هموسیدروز و اضافه بار آهن است، که میتوان آن را به کمک تزریق مرتب دفروکسامین به صورت زیر جلدی یا وریدی تخفیف داد. این دارو با آهن ترکیب شده و از ادرار دفع میشود. البته مقدار زیاد این دارو ممکن است باعث واکنش پوستی در محل تزریق و یا عوارض عصبی به ویژه در دستگاه بینایی و شنوایی شود. بنابراین این دارو به تنهایی برای پیشگیری دراز مدت از مسمومیت با آهن کافی نیست.
برداشتن طحال: اگر بزرگی طحال ، نیاز به تزریق خون را بیشتر کند طحال برداشته میشود تا نیاز به خون کاهش یابد.
پیوند مغز استخوان: درمان قطعی بیماری با پیوند مغز استخوان است. البته این عمل با مرگ ومیر بالایی همراه است. و در برخی بیماران نیز سلولهای تالاسمی مجددا رشد میکنند.
روند بیماری
امروزه با توجه به درمانهای موجود بیماران تا 30 سالگی هم زنده میمانند. و اینها بچههایی با رشد ناقص هستند و شایعترین علت مرگ آنها نارسایی قلبی به علت هموسیدروز و همچنین به علت تزریق خون و افزایش بار قلب میباشد.
تالاسمی مینور
تالاسمی مینور معمولا بدون علامت بوده و علایم بالینی واضح ندارند و بطور عمده در تستهای چکاپ به صورت اتفاقی تشخیص داده میشوند. این افراد کم خونی مختصر (هموگلوبین بیش از 10) با سلولهای گلبول قرمز کوچک و کم رنگ (هیپوکروم میکروسیتر) دارند که معمولا مشکلساز نمیباشد.
تالاسمی مینور در نتیجه اختلال یکی از دو ژن سازنده زنجیره گلوبین بتا به وجود میآید که این ژن ناقص یا از پدر و یا از مادر به فرد به ارث رسیده است، در نتیجه کاهش یا فقدان ساخت زنجیره بتا از یک ژن اتفاق میافتد و به دنبال آن هموگلوبین A2 تا حدود %8-4 افزایش مییابد و گاهی افزایش هموگلوبین F در حدود %1-5 دیده میشود.
تنها نکتهای که در تالاسمی خفیف یا مینور جالب توجه است، این است که این افراد موقع ازدواج نباید با یک فرد شبیه خود (تالاسمی مینور) ازدواج کنند.
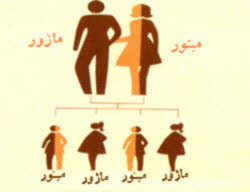
آلفا تالاسمی
علت آلفا تالاسمی حذف یک یا چند ژن از 4 ژن سازنده زنجیره آلفاست، هر چه تعداد ژنهای حذف شده بیشتر باشد بیماری شدیدتر میشود و براساس تعداد ژنهای حذف شده به 4 گروه تقسیم میشوند.
هیدروپس فتالیس: که حذف هر 4 ژن آلفا را دارند و هموگلوبین ساخته شده فقط از زنجیرههای گاما تشکیل شده است که هموگلوبین بارتز گفته میشود و وخیمترین نوع آلفا تالاسمی است و با حیات خارج رحمی منافات دارد و جنین هنگام تولد مرده است و یا مدت کوتاهی پس از تولد میمیرد. این جنینها دچار ادم شدید هستند.
بیماری هموگلوبین H: که در اثر حذف 3 ژن آلفا گلوبین بوجود میآید. بیماران دچار کم خونی هیپوکروم میکروسیتیک بوده و بزرگی طحال در آنها دیده میشود. در بعضی مواقع ممکن است نیاز به تزریق خون داشته باشند و در صورت کم خونی شدید و نیاز به انتقال خون باید طحال برداشته شود.
صفت آلفا تالاسمی 1: که 2 ژن آلفا حذف شده و از هر لحاظ شبیه بتا تالاسمی مینور است.
صفت آلفا تالاسمی 2: که فقط یک ژن از 4 ژن حذف شده و یک حالت ناقل ژن ، خاموش و بدون علامت است.
 انتخاب جراح بینی - بهترین جراح بینی
انتخاب جراح بینی - بهترین جراح بینی  عکس: استهلال ماه مبارک رمضان
عکس: استهلال ماه مبارک رمضان  عکس: ارزش تیم های حاضر در یورو 2016
عکس: ارزش تیم های حاضر در یورو 2016