سلامت
2 دقیقه پیش | نشانه ها و عوارض کمبود ویتامینها در بدنویتامینها نقش مهمی را در بدن انسان ایفا میکنند. بهنحویکه کمبود ویتامین (حتی یکی از آنها) میتواند برای هر فردی مشکلات اساسی را به وجود آورد. گجت نیوز - معین ... |
2 دقیقه پیش | چرا پشه ها بعضی ها را بیشتر نیش میزنند؟فصل گرما و گزیده شدن توسط پشه ها فرا رسیده، دوست دارید بدانید پشه ها بیشتر چه کسانی را دوست دارند؟ بیشتر کجاها می پلکند؟ و از چه مواد دفع کننده ای نفرت دارند؟ وب سایت ... |
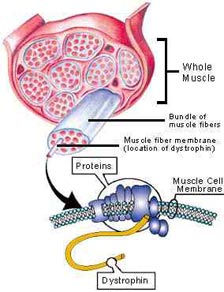
بیماری دیستروفی چیست؟
بیماری دیستروفی - دیستروفی عضلانی(MD) به گروهی از اختلالات عضلانی ارثی غیر التهابی ولی پیشرونده و در عین حال بدون اختلال در سیستم اعصاب مركزی یا محیطی گفته می شود. این بیماری، عضلات را گرفتار كرده و با تخریب فیبرهای عضله همراه است. نخستین گزارش تاریخی درباره دیستروفی عضلانی در سال 1836 توسط كنت و جیوجا داده شد كه در آن به شرح دو برادر پرداخته بودند كه ضعف عضلانی پیشرونده آنها در ده سالگی آغاز شده بود.با این حال در سال 1852، اولین گزارش جامع در مورد این بیماری توسط مریون نوشته شد و فرضیه انتقال ژنتیكی از زنان به مردان و ابتلای آنان را بیان نمود.
در سال 1868 دوشن عصب شناس فرانسوی، به خاطر پژوهش های گسترده و كمك هایش برای درك بیماری عضله، یكی از شدیدترین و شاخص ترین انواع دیستروفی عضلانی را به نام خود ثبت نمود. پیدایش و پیشرفت روش های زیست شناسی مولكولی موجب شد تا نقص در رمز وراثتی پروتئینی مربوط به سلول های عضله اسكلتی (دیستروفین) تشخیص داده شود. نقص درکمپلکس پروتئینی مربوط به درون بافت ماهیچه ای سلول،انواع دیستروفی را ایجاد می کند. یکی از اصلی ترین شاخص های بیوشیمیایی در فرآیند تشخیص بیماران دیستروفی افزایش مقدار (CPK) در اثر نشت اجزای درون سلولی به خارج از سلول میباشد. با افزایش شناخت از روند دیستروفی در بیماران مختلف، مشخص گردید که انواع مختلفی از دیستروفی ها وجود دارند.
عمده ترین انواع دیستروفی ها :
الف) دیستروفی های عضلانی وابسته به جنس شامل:
• دوشن (DMD)؛ بكر (BMD)؛ امری دریفوس می باشد.
ب )دیستروفی های عضلانی اتوزومال غالب شامل :
• فاسیواسكاپولوهومورال (صورتی كتفی بازویی) ؛دیستال ؛اكولار؛اكولوفارنژیال می باشد.
ج) دیستروفی عضلانی اتوزومال مغلوب شامل دیستروفی عضلانی كمربند شانهای (LGMD)است.
افتراق میان انواع دیستروفی کاری دشوار ولی امکان پذیر توسط روش های مولکولی و ایمونوهیستوشیمی است.
ملاحظات تغذیه ای در بیماری های دیستروفی عضلانی
در انواع بیماری های دیستروفی عضلانی، بیماران از لحاظ تغذیه ای با مشكلات مشتركی مواجهند كه در صورت عدم توجه به آن، عواقب ناگواری از جمله چاقی، پوكی استخوان، كمبود پروتئین، یبوست برای بیمار به دنبال خواهد داشت. پزشكان مصرف مواد مغذی آنتی اكسیدان مانند ویتامین E وكوانزیم Q را برای بیماران توصیه میكنند.
كاردرمانی، ورزش درمانی و فیزیوتراپی
بد نشستن و بد ایستادن در اثر ضعف عضلانی و عدم تعادل ممكن است باعث انقباض های ساختمانی بافت نرم وبدریختی های ستون مهره ها گردد. از آنجا که استفاده از صندلی چرخ دار نیز منجر به وخامت این انقباض ها و پیشرفت اسكولیوز (انحراف جانبی ستون مهره ها) میشود، بنابراین باید سعی نمود تا بیماران سال های بیشتری توانایی راه رفتن را حفظ نمایند.
برای اقداماتی که باید توسط کاردرمانگر انجام شود براساس روند مشخص بیماری، سه مرحله جداگانه در نظر گرفته میشود.
مرحله اول- از زمان تشخیص تا زمانی كه فرد در بالا رفتن از پله دچار مشكل گردد. بهترین روش در این دوران تشویق به راه رفتن، تمرینات كششی توسط فیزیوتراپیست برای اندام فوقانی و تحتانی واستفاده از اسپیلینت های گوناگون در شب برای جلوگیری از ایجاد دفورمیتی در مچ پا و یا دست می-باشد.
مرحله دوم- از زمانی كه فرد در راه رفتن دچار مشكل شود و برای جابجایی در بیرون از منزل از ویلچر استفاده كند. در این دوران نوع ویلچر باید توسط كاردرمان تعیین و نحوه استفاده از آن آموزش داده شود. هنگام نشستن در ویلچر، میزان تكیه دادن به عقب، وضعیت لگن و زاویه آن با تنه، استفاده از جاهای پا و زاویه زانوها اهمیت فوق العاده دارد.
مرحله سوم- زمانی كه فرد برای جابجایی در بیرون و داخل منزل از ویلچر استفاده كند. در این دوران به علت عدم توانایی در راه رفتن، اسكولیوز (انحراف جانبی ستون مهرهها) سریع تر ظاهر می گردد. معمولا این دفورمیتی منجر به كاهش حجم قفسه سینه میشود. همچنین در این دوران به علت ضعف ایجاد شده در اندام فوقانی نیاز به استفاده از وسایل کمکی الکتریکی و مکانیکی می باشد.
شنا از فعالیت های بسیار مناسب در این مرحله است زیرا شنا کردن به روی کمر برای حفاظت از پشت بسیار مفید می باشد.با توجه به تنوع دیستروفی ها و شیوه های متفاوت پیشروی بیماری، لازم است مشاوره های بموقع و مناسبی صورت گیرد تا پیشگیری روند بیماری را کندتر سازد.
درمان های پزشکی
الف) دارویی :
در حال حاضر یکی از مشتقات پردنیزولین به نام دفلازاکورت به عنوان گزینه درمانی مطرح شده است. دفلازاکورت باعث حفظ استحکام استخوان و نگهداری ذخیره کربوهیدرات شده و در نتیجه کمتر از استروئیدهای با دوز بالا باعث وزنگیری میشود و در نتیجه قدرت و کارایی بیمار را افزایش می دهد. این دارو به علت کم بودن اثرات جانبی و داشتن خواص سودمند در نگهداری عضله و به تاخیر انداختن پیشرفت اسکولیوز در همه بیماران حتی در بیمارانی که کاملا وابسته به صندلی چرخ دار هستند مورد استفاده قرار می گیرد.
ب) ژن درمانی
ژن درمانی سوماتیک در بیماران دوشن روش درمانی نوین دیگری است که تحقیقات بسیاری بر روی آن انجام می شود. در این روش درمانی، میوبلاست های نارس سالم را وارد عضلات می کنند، که در آنجا به سلول های عضله ملحق می شود و برای جلوگیری از روند تخریب پیشرونده عضلات گرفتار، به مقدار کافی دیستروفین تولید می کند. سایر روش های مولکولی درمان شامل انتقال نسخه های نوترکیب ژن دیستروفین با استفاده از ناقل های ویروسی یا غیرویروسی، و الیگونوکلئوتیدهای آنتی سنس است.
ج) جراحی:
پیش از انجام مداخله جراحی، باید وضعیت كلی هر بیمار در نظر گرفته شود و بنا به نظر متخصصین، جراحی انجام شود. همچنین باید تمامی وسایل كمكی مورد نیاز از جمله ساپورت برای گردن و پشت، تخت الكتریكی، سطح میز قابل تنظیم و ... قبل از انجام عمل جراحی تهیه گردد.نمونه ای از این مداخلات جراحی جوش دادن بخش خلفی ستون مهره ها به لگن است که موجب صاف شدن اسكولیوز شده و امكان تعادل بهتر را در هنگام راست نشستن فراهم میكند.
منبع:dystrophy.ir
ویدیو مرتبط :
درمان بیماری دیستروفی
خواندن این مطلب را به شما پیشنهاد میکنیم :
تالاسمی یک بیماری ارثی-ژنتیکی

تالاسمی نوعی کم خونی ارثی و ژنتیکی است که به علت اشکال در ساخت زنجیرههای پروتئینی هموگلوبین بوجود میآید.هموگلوبین مولکول اصلی داخل گویچههای قرمز است که از هم و زنجیرههای پروتئنی یا گلوبین تشکیل شده است. در هر زنجیره گلوبین یک مولکول هم وجود دارد که اکسیژن را توسط آهن خود حمل میکند. پس تولید هموگلوبین نیاز به تامین آهن و ساخت هموگلوبین دارد بر اساس نوع زنجیره پروتئینی چند نوع هموگلوبین وجود دارد:
هموگلوبین A: هموگلوبین طبیعی در بالغین عمدتا همولگوبین A میباشد که تقریبا حدود 98% از هموگلوبین جریان خون را تشکیل میدهد و از زنجیره 4 تایی حاوی دو زنجیره آلفا و دو زنجیره بتا ساخته میشود. (α2β2)
HGbA2: هموگلوبین A2 از 2 زنجیره آلفا و 2زنجیره بتا تشکیل میشود.(α2δ2) که بطور طبیعی 2-1% هموگلوبین در بالغین را تشکیل میدهد.
HGbF: هموگلوبین F که هموگلوبین اصلی دوران جنینی است و کمتر از 1% هموگلوبین در بالغین را نیز شامل میشود،از زنجیره 4 تایی 2 تا آلفا و 2 تا گاما (α2δ2) تشکیل گردیده است و هموگلوبین های C , H و ... که در بعضی بیماریها بوجود میآید.
برای ساخت زنجیره بتا هر فرد از هر والد خود (پدر و مادر) یک ژن سازنده این زنجیره را دریافت میکند و برای زنجیرههای δ,α از هر والد 2 ژن دریافت میکند. و بر اساس جهش یا حذف هر کدام از این ژنها ساخت و زنجیره مربوطه مختل شده و انواع بیماری تالاسمی را خواهیم داشت.
هموگلوبین نه تنها برای حمل و تحویل طبیعی اکسیژن لازم است، بلکه در شکل و اندازه و بدشکلی گلبول قرمز دخالت دارد. مقدار کل هموگلوبین خون بطور طبیعی در خانمها 2±12 و در آقایان 2±14 گرم در دسیلیتر میباشد.
انواع تالاسمی
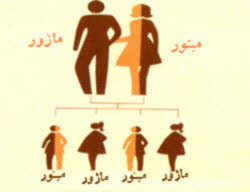
تالاسمی به دو نوع آلفا تالاسمی و بتا تالاسمی است که خود بتا تالاسمی هم شامل تالاسمی ماژور (تالاسمی شدید) و تالاسمی مینور یا تالاسمی خفیف میباشد. افراد مبتلا به تالاسمی مینور در واقع کم خونی مشکلسازی ندارندریا، ولی اگر دو فرد تالاسمی مینور با هم ازدواج کنند به احتمال 25% فرزندنشان دچار تالاسمی شدید ماژور خواهد بود و 25% فرزندشان سالم و 50% تالاسمی مینور خواهند داشت.
تالاسمی ماژور
تالاسمی ماژور یا آنمی کولی به علت حذف یا جهش در هر دو ژن سازنده زنجیره بتا ایجاد میشود و به این ترتیب یا هیچ زنجیره بتایی ساخته نمیشود و یا به مقدار کمی ساخته میشود. در نتیجه بدن کمبود این زنجیرهها را با ساخت زنجیرههای آلفا جبران میکند که این زنجیرههای آلفای اضافی برای گلبولهای قرمز سمی هستند و با رسوب بر روی سلولهای گلبول قرمز باعث میشوند که گلبولهای قرمز در مغز استخوان و در داخل خون تخریب شده و زنجیرههای آلفا در مغز استخوان رسوب میکنند. از طرفی به علت خونسازی غیر موثر ، مراکز خونساز خارج مغز استخوان ، ار جمله کبد و طحال شروع به خونسازی میکنند و بزرگ میشوند.
بیماری معمولا بصورت کم خونی شدید در 6 ماهه اول زندگی کودک تظاهر میکند و درصورت عدم شروع تزریق خون ، بافت مغز استخوان و مکانهای خونساز خارج مغز استخوان فعال و بزرگ شده و باعث بزرگی مغز استخوانها بخصوص استخوانهای پهن (صورت و جمجمه) و بزرگی کبد و طحال میشوند.

علایم بیماری
کم خونی شدید طوریکه برای بقاء بیمار تزریق مکرر خون لازم است.
افزایش حجم شدید مغز استخ
وان بخصوص در استخوانهای صورت و جمجمه ، چهره خاص افراد تالاسمی را ایجاد میکند (چهره موش خرمایی).
اختلال رشد دربچههای بزرگتر
رنگ پریدگی ، زردی و گاهی پوست ممکن است به دلیل رنگ پریدگی و یرقان و رسوب ملانین به رنگ مس در آید.
بزرگی کبد و طحال ، در سنین بالاتر گاهی طحال به حدی بزرگ میشود که باعث تخریب بیشتر گلبولهای قرمز میشود.
علایم ناشی از رسوب آهن در بافتهای مختلف از جمله پانکراس و قلب و غدد جنسی و ایجاد دیابت و نارسایی قلبی و تاخیر در بلوغ.
استخوانها نازک شده و مستعد شکستگی میشوند.
تشخیص
در آزمایش خون تالاسمی ماژور گلبولهای قرمز خون کوچک و کم رنگ خواهد بود (کم خونی هیپوکروم میکروسیتر). افت شدید هموگلوبین به مقادیر کمتر از 5 گرم در دسی لیتر وجود دارد. بیلی روبین سرم به علت تخریب سلولها افزایش مییابد و سایر آزمایشات که لزومی برای گفتن همه آنها نیست. تشخیص قطعی با الکتروفورز هموگلوبین انجام میشود که در تالاسمی ماژور هموگلوبین A طبیعی ساخته نمیشود و 98% هموگلوبینها را هموگلوبین F تشکیل میدهد و هموگلوبین A2 نیز تا 5% افزایش پیدا میکند.
عوارض
از عوارض تالاسمی یک سری از عوارض از جمله اختلال رشد و تغییر قیافه بیمار و بزرگی کبد و طحال که به علت خود بیماری است و یکسری عوارض دیگر ناشی از درمان تالاسمی است. اصلیترین این عارضه هموسیدوز یا هموکروماتوز است.
هموسیدروز به رسوب آهن در بافتها گفته میشود که نتیجه غیر قابل اجتناب تزریق طولانی مدت خون است. در هم نیم لیتر خونی که به بیمار تزریق میشود، حدود 200mg آهن به بافتها منتقل میکند که این مقدار آهن نمیتواند از بدن دفع شود و در بافتها رسوب میکند و باعث نارسایی در بافتها میگردد. بخصوص رسوب آهن در قلب و پانکراس و غدد ، مشکل اصلی این بیماران خواهد بود که باعث نارسایی پانکراس و دیابت ، نارسایی قلبی و نارسایی غدد جنسی و تیروئید و ... میشود.
درمان
تالاسمی شدید و درمان نشده همیشه باعث مرگ در دوران کودکی میگردد. در صورت تزریق مکرر خون و حفظ سطح مناسبی از خون میتوان طول عمر ا افزایش داد و تا حد زیادی مانع از تغییرات استخوانی و اختلال رشد گردید. پس درمان تالاسمی عبارتند از:
تزریق دراز مدت خون: هدف از تزریق خون مکرر برای بیمار حفظ هموگلوبین بیمار در سطح بالای 10 است.
دفروکسامین: مشکل اصلی بیماران تالاسمی بعد از سالها ، هموسیدروز و اضافه بار آهن است، که میتوان آن را به کمک تزریق مرتب دفروکسامین به صورت زیر جلدی یا وریدی تخفیف داد. این دارو با آهن ترکیب شده و از ادرار دفع میشود. البته مقدار زیاد این دارو ممکن است باعث واکنش پوستی در محل تزریق و یا عوارض عصبی به ویژه در دستگاه بینایی و شنوایی شود. بنابراین این دارو به تنهایی برای پیشگیری دراز مدت از مسمومیت با آهن کافی نیست.
برداشتن طحال: اگر بزرگی طحال ، نیاز به تزریق خون را بیشتر کند طحال برداشته میشود تا نیاز به خون کاهش یابد.
پیوند مغز استخوان: درمان قطعی بیماری با پیوند مغز استخوان است. البته این عمل با مرگ ومیر بالایی همراه است. و در برخی بیماران نیز سلولهای تالاسمی مجددا رشد میکنند.
روند بیماری
امروزه با توجه به درمانهای موجود بیماران تا 30 سالگی هم زنده میمانند. و اینها بچههایی با رشد ناقص هستند و شایعترین علت مرگ آنها نارسایی قلبی به علت هموسیدروز و همچنین به علت تزریق خون و افزایش بار قلب میباشد.
تالاسمی مینور
تالاسمی مینور معمولا بدون علامت بوده و علایم بالینی واضح ندارند و بطور عمده در تستهای چکاپ به صورت اتفاقی تشخیص داده میشوند. این افراد کم خونی مختصر (هموگلوبین بیش از 10) با سلولهای گلبول قرمز کوچک و کم رنگ (هیپوکروم میکروسیتر) دارند که معمولا مشکلساز نمیباشد.
تالاسمی مینور در نتیجه اختلال یکی از دو ژن سازنده زنجیره گلوبین بتا به وجود میآید که این ژن ناقص یا از پدر و یا از مادر به فرد به ارث رسیده است، در نتیجه کاهش یا فقدان ساخت زنجیره بتا از یک ژن اتفاق میافتد و به دنبال آن هموگلوبین A2 تا حدود %8-4 افزایش مییابد و گاهی افزایش هموگلوبین F در حدود %1-5 دیده میشود.
تنها نکتهای که در تالاسمی خفیف یا مینور جالب توجه است، این است که این افراد موقع ازدواج نباید با یک فرد شبیه خود (تالاسمی مینور) ازدواج کنند.
آلفا تالاسمی
علت آلفا تالاسمی حذف یک یا چند ژن از 4 ژن سازنده زنجیره آلفاست، هر چه تعداد ژنهای حذف شده بیشتر باشد بیماری شدیدتر میشود و براساس تعداد ژنهای حذف شده به 4 گروه تقسیم میشوند.
هیدروپس فتالیس: که حذف هر 4 ژن آلفا را دارند و هموگلوبین ساخته شده فقط از زنجیرههای گاما تشکیل شده است که هموگلوبین بارتز گفته میشود و وخیمترین نوع آلفا تالاسمی است و با حیات خارج رحمی منافات دارد و جنین هنگام تولد مرده است و یا مدت کوتاهی پس از تولد میمیرد. این جنینها دچار ادم شدید هستند.
بیماری هموگلوبین H: که در اثر حذف 3 ژن آلفا گلوبین بوجود میآید. بیماران دچار کم خونی هیپوکروم میکروسیتیک بوده و بزرگی طحال در آنها دیده میشود. در بعضی مواقع ممکن است نیاز به تزریق خون داشته باشند و در صورت کم خونی شدید و نیاز به انتقال خون باید طحال برداشته شود.
صفت آلفا تالاسمی 1: که 2 ژن آلفا حذف شده و از هر لحاظ شبیه بتا تالاسمی مینور است.
صفت آلفا تالاسمی 2: که فقط یک ژن از 4 ژن حذف شده و یک حالت ناقل ژن ، خاموش و بدون علامت است.
 انتخاب جراح بینی - بهترین جراح بینی
انتخاب جراح بینی - بهترین جراح بینی  عکس: استهلال ماه مبارک رمضان
عکس: استهلال ماه مبارک رمضان  عکس: ارزش تیم های حاضر در یورو 2016
عکس: ارزش تیم های حاضر در یورو 2016